
凯思凯迪(上海)医药科技有限公司正在开展一项评价CS0159片治疗原发性硬化性胆管炎患者的安全性、耐受性和有效性的多中心、随机、12周双盲、安慰剂对照及40周开放的II期临床研究(研究方案号为PSC-CS0159-003),该研究已获得国家食品药品监督管理总局的批准(通知书编号为2022LP00119),计划在中国大陆的约12家医院进行,共计招募约50名原发性硬化性胆管炎患者。
关于CS0159
CS0159是一种基于晶体结构辅助设计获得的新型强效非甾体类法尼醇X受体(FXR)小分子激动剂,由凯思凯迪创始人徐华强研究员和上海药物所李佳课题组联合自主研发。现已获包括NASH、PSC、PBC在内的3个适应症的临床试验批件,临床I期已完成,针对不同适应症的临床II期试验正在中、美推进中。
招募主要条件:
1.年龄≥18周岁且≤75周岁,男女不限;
2.在过去12个月内经胆道造影(磁共振胰胆管造影MRCP、内镜逆行胆管造影ERCP或经皮肝穿刺胆管造影PTC)任何一种方式诊断为PSC;
3.筛选时碱性磷酸酶(ALP)≥1.50×ULN且≤10×ULN和总胆红素≤3×ULN ;
4.随机前服用UDCA(≤25mg/kg/d)≥6个月且稳定剂量≥3个月或随机前未使用UDCA≥3个月;
5.对于有IBD病史的受试者:a)患有克罗恩病的患者必须处于疾病缓解期,b)患有溃疡性结肠炎的患者必须处于疾病缓解期或仅轻度活动期;
6.能理解研究内容,依从研究方案,并资源签署ICF。
如果您符合研究条件,并自愿同意参加,请联系相关医生做进一步筛查,如果评估后符合研究要求,您将获得由申办方提供的药物进行治疗,其研究期间相关检查的费用由申办方支付。
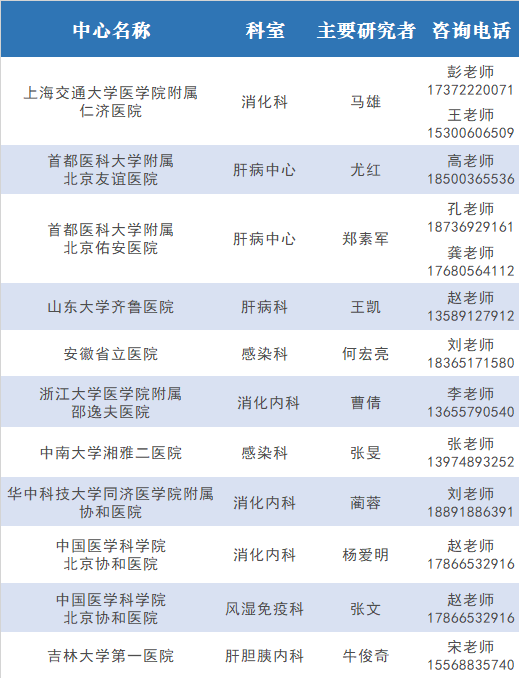
将有更多临床中心加入该临床试验,临床中心陆续更新中,如您有任何疑问可咨询陈老师(18721229694)

 沪ICP备2021036600号-1
沪ICP备2021036600号-1